Exposition prénatale à l’alcool: ses effets et ses répercussions
Septembre 2018/Vol.7, no.1
Les recherches en cours dans le laboratoire du Dr Serge McGraw, du Centre de Recherche en Reproduction et Fertilité (CRRF) de l’Université de Montréal, permettent d’identifier précisément les déficiences induites par l’exposition prénatale à l’alcool sur les jeunes embryons.
Les premières étapes du développement embryonnaire sont critiques afin d’assurer la survie et la santé de l’embryon. Par conséquent, toute perturbation pendant cette période peut entraîner de graves conséquences chez le futur nouveau-né. Notamment, une mauvaise mise en place du programme épigénétique embryonnaire au cours de ces premiers jours aura des effets délétères au niveau de divers processus clés dans le développement de l’embryon.
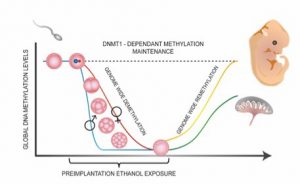
Une étape cruciale dans l’établissement de ce programme est une vague de reprogrammation des profils de méthylation de l’ADN, qui s’entame suite à la fécondation de l’ovule. La méthylation de l’ADN est, entre autres, impliquée dans la répression de la transcription, la stabilité du génome et l’inactivation du chromosome X. Cette modification se fait par l’entremise d’enzymes spécifiques, appelées méthyltransférases (ou DNMTs) et se produit à des endroits spécifiques de l’ADN, plus précisément sur les séquences cytosines-guanines (CpG)(Canovas and Ross 2016; McGraw et al, 2018). Pendant la vague de reprogrammation, la grande majorité des profils de méthylation de l’ADN du génome sont effacés (sauf au niveau de certaines séquences clés où le maintien de la méthylation est essentiel).
A la suite de son implantation dans l’utérus, le jeune embryon établira ses propres marques de méthylation d’ADN afin d’acquérir une indépendance épigénétique pour réguler lui-même l’expression de gènes importants pour des processus développementaux telle que la différenciation cellulaire. La période de reprogrammation épigénétique est une période extrêmement dynamique, se produisant essentiellement pendant la première semaine de vie de l’embryon (Reik, Dean, and Walter 2001; Messerschmidt, Knowles, and Solter 2014).
Plusieurs études ont démontré que cette période est sensible aux perturbations provenant de l’environnement extérieur ou aux dérèglements génétiques. Des expositions néfastes provenant de l’environnement maternel (e.g., nutrition, prise de drogue ou de médicaments, etc.) ou certaines mutations dans des gènes clés (e.g., DNMT3a) peuvent engendrer des erreurs dans le paysage épigénétique embryonnaire. Ces erreurs ont le potentiel d’être perpétuées au cours du développement et avoir diverses conséquences sur la santé de l’enfant (e.g., troubles neurodéveloppementaux)(Watkins, Lucas, and Fleming 2010).
Recherches en cours dans le laboratoire du Dr McGraw
L’équipe du Dr Serge McGraw étudie les conséquences néfastes associées à une perturbation au niveau de la vague de reprogrammation de la méthylation de l’ADN. Entre autres, ils veulent déterminer les répercussions d’une exposition prénatale à l’alcool pendant la période préimplantatoire.
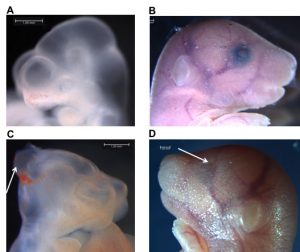
En effet, vu le nombre important de grossesses non-planifiées (environ 40%, 85 millions par an à travers le monde (Sedgh, Singh, and Hussain 2014), de nombreuses femmes exposent précocement leurs jeunes embryons à des niveaux aigus d’alcool, par ignorance, au cours des premières semaines de gestation. L’alcool est d’ailleurs reconnu pour inhiber le fonctionnement des enzymes DNMTs en plus d’interférer dans le métabolisme du folate et de l’homocystéine / méthionine (Kobor and Weinberg 2011; Varela-Rey et al. 2013). Cela a pour conséquence de réduire la disponibilité en groupements méthyles nécessaires lors de la reprogrammation épigénétique. Le Dr McGraw utilise la souris comme modèle afin de déterminer les déficiences phénotypiques, moléculaires et cognitives permanentes initiées par l’exposition prénatale des jeunes embryons à l’alcool. Une ancienne doctrine en toxicologie favorise le concept de « tout ou rien », signifiant qu’une exposition néfaste lors de l’organogenèse entraînera soit la mort embryonnaire ou aucune conséquence. Les travaux du Dr McGraw démontrent plutôt qu’une exposition à l’alcool pendant cette période a des conséquences néfastes sur l’embryon, sans toutefois entraîner sa mort. D’ailleurs ses résultats confirment que cette exposition entraîne la dérégulation des profils de méthylation d’ADN dans le cerveau embryonnaire à mi-gestation ainsi qu’une augmentation d’anomalies morphologiques (e.g., retards de croissance, difformités du cerveau). De plus, les plus récentes expériences démontrent que ces conséquences moléculaires ont des impacts à long terme sur les fonctions cognitives du cerveau puisque les souris adultes ont divers déficits de mémoire et d’habiletés sociales et ce, même sur des souris à l’apparence normale.
Conclusions et perspectives
L’environnement auquel est exposé l’embryon au cours de ses premiers jours de vie peut jouer un rôle majeur dans la santé à long terme de l’enfant par le biais de la perturbation des mécanismes épigénétiques. En modélisant les effets néfastes d’une exposition maternelle à l’alcool grâce à des outils informatiques, l’équipe du Dr McGraw espère comprendre comment des erreurs induites dans le programme épigénétique embryonnaire peuvent mener à l’apparition de troubles neurodéveloppementaux et s’il est possible de les corriger éventuellement.
Références
Canovas, S., and P. J. Ross. 2016. ‘Epigenetics in preimplantation mammalian development’, Theriogenology, 86: 69-79.
Kobor, M. S., and J. Weinberg. 2011. ‘Focus on: epigenetics and fetal alcohol spectrum disorders’, Alcohol Res Health, 34: 29-37.
Legault, L. M., V. Bertrand-Lehouillier, and S. McGraw. 2018. ‘Pre-implantation alcohol exposure and developmental programming of FASD: an epigenetic perspective’, Biochem Cell Biol, 96: 117-30.
Legault, Lisa-Marie. 2018. ‘Identification de dérèglements épigénétiques embryonnaires associés à une exposition prénatale à l’alcool pendant la période préimplantatoire’. Mémoire de maîtrise.
Messerschmidt, D. M., B. B. Knowles, and D. Solter. 2014. ‘DNA methylation dynamics during epigenetic reprogramming in the germline and preimplantation embryos’, Genes Dev, 28: 812-28. Reik, W., W. Dean, and J. Walter. 2001. ‘Epigenetic reprogramming in mammalian development’, Science, 293: 1089-93.
Sedgh, G., S. Singh, and R. Hussain. 2014. ‘Intended and unintended pregnancies worldwide in 2012 and recent trends’, Stud Fam Plann, 45: 301-14.
Varela-Rey, M., A. Woodhoo, M. L. Martinez- Chantar, J. M. Mato, and S. C. Lu. 2013. ‘Alcohol, DNA methylation, and cancer’, Alcohol Res, 35: 25-35.
Watkins, A. J., E. S. Lucas, and T. P. Fleming. 2010. ‘Impact of the periconceptional environment on the programming of adult disease’, J Dev Orig Health Dis, 1: 87-95.
Sources de financement : SickKids Foundation, Centre de recherche du CHU Ste-Justine, Université de Montréal.
Support salarial : Instituts de recherché en santé du Canada (bourse d’étude à LM. Legault), Fonds de recherche du Québec – Santé Junior 1 (S. McGraw).